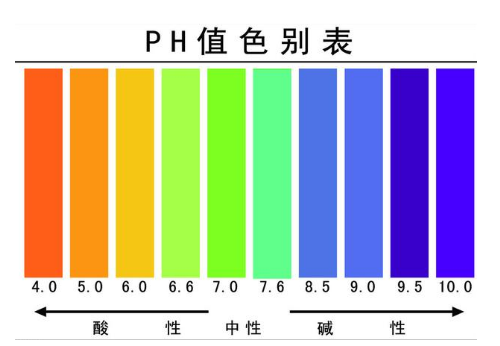
pH的概念
pH值,又称酸碱值,是溶液或物质中氢离子活度的一种标度,也就是通常意义上溶液或物质酸碱度的衡量标准。pH值分为0-14范围,一般从0-7属酸性,从7-14属碱性,7为中性。任何物质都具有其自身的酸碱属性。
土壤pH值
土壤的酸碱性是土壤胶体的固液相的综合表现,在土壤溶液中由游离的H+或HO-显示出来。酸性土壤的溶液中,含的H+比OH-多,显酸性,碱性土壤的溶液中HO1比H+多,显碱性。土壤胶粒上阳离子的组成决定了土壤的酸碱反应。土壤酸碱性与土壤的盐基饱和度有关,一般盐基不饱和的土壤(土壤胶粒上有较多的致酸离子Al3+和H+)呈酸性反应,而盐基饱和的土壤则呈中性或碱性。
土壤酸度,又称为土壤的总酸度,是有两部分组成,活性酸度(酸性强度)和潜在酸度(酸度数量)。土壤酸碱性是土壤的重要化学性质。土壤的酸碱性直接影响作物的生长和微生物的活动以及土壤的其他性质与肥力状况等。
土壤中八大离子:钾离子,钠离子,钙离子,镁离子,氯离子,硫酸根离子,碳酸氢根离子,碳酸根离子。
土壤酸性分类以及产生的原因
土壤酸碱度几级:<4.5极强酸性、4.5—5.5强酸性、5.5—6.5酸性、6.5—7.5中性。
土壤酸性的来源:
(1)土壤之所以呈酸性反应,是因为土壤含有致酸物质,如酸性盐、有机酸、无机酸,更主要的是胶体带有大量的致酸离子H+和Al3+(水解后产生H+)。
(2)在高温高湿的条件下,土壤风化作用强烈,同时强烈的淋溶作用使大量的盐基被淋失,而吸附力极强的Al3+和H+较多时,H+进入矿物晶格,对矿物产生一定的破坏作用,使其中的Al3+成为交换性Al3+,交换性Al3+水解,又产生相当量的游离H+,从而使土壤显酸性反应,这是土壤酸性的主要原因。
(3)植被的类型和母质的成分以及不同的农业措施对土壤酸性的发展也有影响,例如有机质可形成较多的富里酸,使土壤进行酸性淋溶,加速盐基的淋失,使土体中H+增多。
(4)土壤微生物和根系呼吸产生的CO2和有机质分解产生的有机酸,也可增加土壤溶液中的H+。
(5)一些矿物成分中含有酸性基如黄铁矿(FeS)等,经氧化而产生硫酸。
(6)农业上施用生理酸性肥料如硫胺或明矾,都有大量酸根残留在土中。其中酸性污水、酸雨等也可使土壤急剧酸化。
土壤酸性对作物生长的影响
在很多情况下pH对植物生长的影响,是pH对土壤养分有效性的影响。土壤养分的有效度在不同pH值条件下差异很大。
pH随土壤溶液中的钙和镁含量增加而增加,钙和镁的有效性在pH<6的范围内,随pH较低的范围,也随pH增大而提高。在pH低时,钼和镁形成难溶性化合物而变得无效。
在强酸性土壤上有些植物如柑橘会发生缺钼现象,铁、锰、钼的有效性是随pH的降低而提高,在强酸性土壤,铁、铝、锰的浓度提高,常使植物受到毒害作用,而石灰性或碱性土壤,铁、锰的有效性很低,植物有往往发生缺铁症状。
从整体来看,大多数土壤养分在pH6.5(中性)附近的有效性较高。
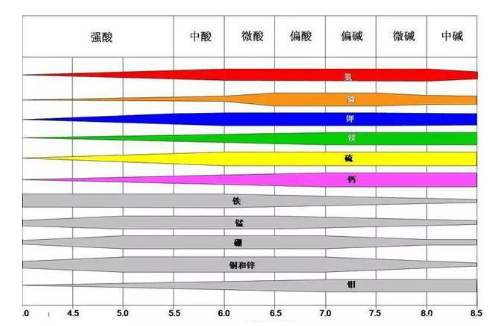
各元素不同pH值下的有效性
氮在6~8时有效性较高,是由于在小于6时,固氮菌活动降低,而大于8时,硝化作用受到抑制。
磷在6.5~7.5时有效性较高,在小于6.5的酸性土壤中,磷常与铁、铝等离子化合产生沉淀,或被固定为不溶性的铁、铝磷酸盐,大大降低了土壤中磷素的有效性。在高于7.5的土壤中,则易形成磷酸二氢钙。
钾和硫的有效性随土壤pH的变化表现出基本一致的趋势。土壤pH值低于6,钾的淋溶作用强烈,因此有效性降低,但碱性土壤并不会削弱土壤钾的有效性。
植物能直接吸收利用的硫是SO4-和游离氨基酸硫,土壤中硫磺的氧化可以得到有效态硫,而有研究发现,土壤pH值与硫磺氧化速率呈正相关,这是因为碱性条件可以促进硫氧化微生物的活动,加快硫磺的氧化。甚至在pH高于10的强碱性土壤中,提高pH依然能促进硫磺的氧化。
钙和镁对土壤pH的反应规律基本相同,过酸或者过碱都会削弱其有效性,土壤pH为6-8时,有效性最高。这是因为酸性土壤的淋溶作用强烈,钙、镁容易流失,导致缺乏。而在pH高于8.5时,土壤钠离子增加,钙、镁离子被取代,形成碳酸盐沉淀,因此钙、镁的有效性同样降低。
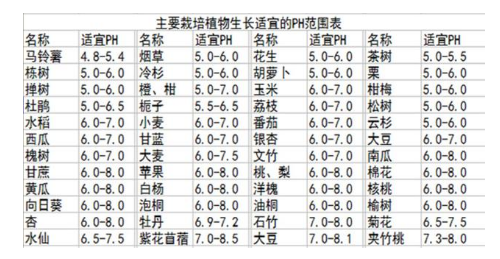
不同作物对土壤酸碱性的适应性
土壤酸度的调节
土壤酸性主要有胶体吸附的交换性H+和Al3+所控制,在改良土壤酸性时,不仅要中和活性酸,而且主要是中和潜在酸,才能从根本上改善土壤的酸性,通常是使用石灰来改良土壤酸性;即用Ca2+或Mg2+把土壤胶体上致酸离子代换下来,并在土壤溶液中被中和掉。
弊端:用石灰调理土壤,会造成土壤板结,保水保肥能力下降,造成肥料浪费等恶性循环。
微生物菌调理土壤酸性:通过补充土壤中有益微生物的含量,改善作物根际环境,促进土壤有机质含量,转化土壤中化学元素为速效性,被作物吸收后,减轻土壤中酸性元素的积累。



